Công nghệ in 3D sinh học sử dụng chính tế bào của bệnh nhân
Công nghệ in 3D sinh học (Bioprinting) sử dụng chính tế bào của bệnh nhân là một cuộc cách mạng trong y học tái tạo, mở ra khả năng tạo ra các mô và cơ quan tùy chỉnh, phù hợp hoàn hảo với nhu cầu điều trị của từng cá nhân. Thay vì sử dụng vật liệu nhân tạo, bioprinting tận dụng tế bào sống của chính bệnh nhân để xây dựng các cấu trúc sinh học phức tạp, giảm thiểu nguy cơ thải ghép và tối ưu hóa khả năng tương thích sinh học. Quá trình này bao gồm việc lấy mẫu tế bào từ bệnh nhân, nhân chúng lên, trộn với vật liệu sinh học (bioink), và sử dụng máy in 3D đặc biệt để tạo ra các cấu trúc mong muốn theo thiết kế số. Các cấu trúc này sau đó được nuôi cấy trong môi trường đặc biệt để phát triển thành mô hoặc cơ quan hoàn chỉnh.
Quy trình và kỹ thuật trong Bioprinting sử dụng tế bào tự thân
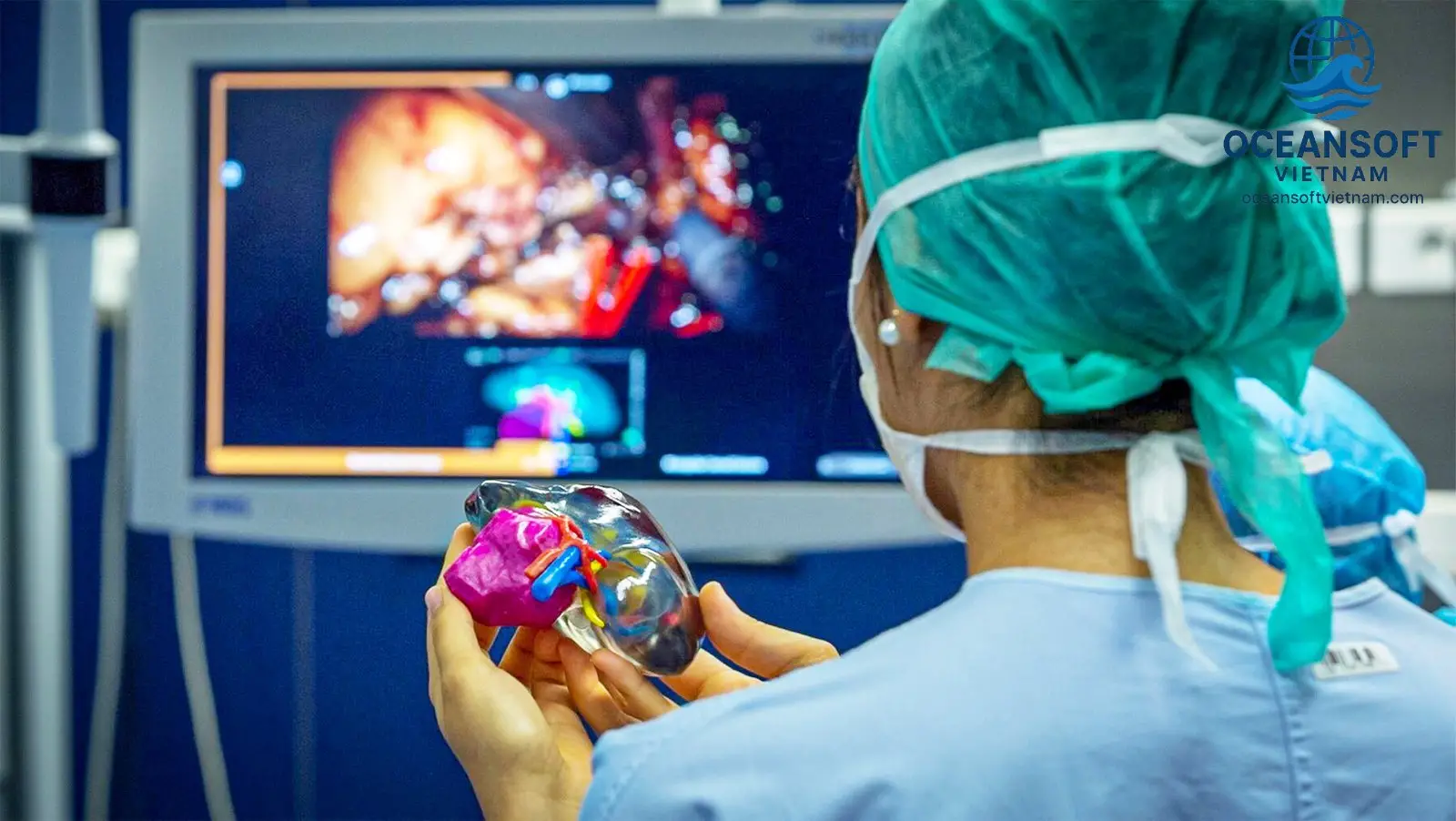
Các bước cơ bản của quy trình Bioprinting
Quy trình in 3D sinh học thường bao gồm ba giai đoạn chính: chuẩn bị, in và xử lý hậu kỳ.
Chuẩn bị: Giai đoạn này bao gồm việc thiết kế mô hình 3D của cấu trúc cần in, thường dựa trên hình ảnh chụp cắt lớp vi tính (CT) hoặc cộng hưởng từ (MRI). Tế bào của bệnh nhân được thu thập thông qua sinh thiết, sau đó được nhân lên và trộn với bioink. Bioink là một hỗn hợp các tế bào, vật liệu nền (như hydrogel) và các yếu tố tăng trưởng, cung cấp môi trường sống và hỗ trợ cấu trúc cho tế bào.
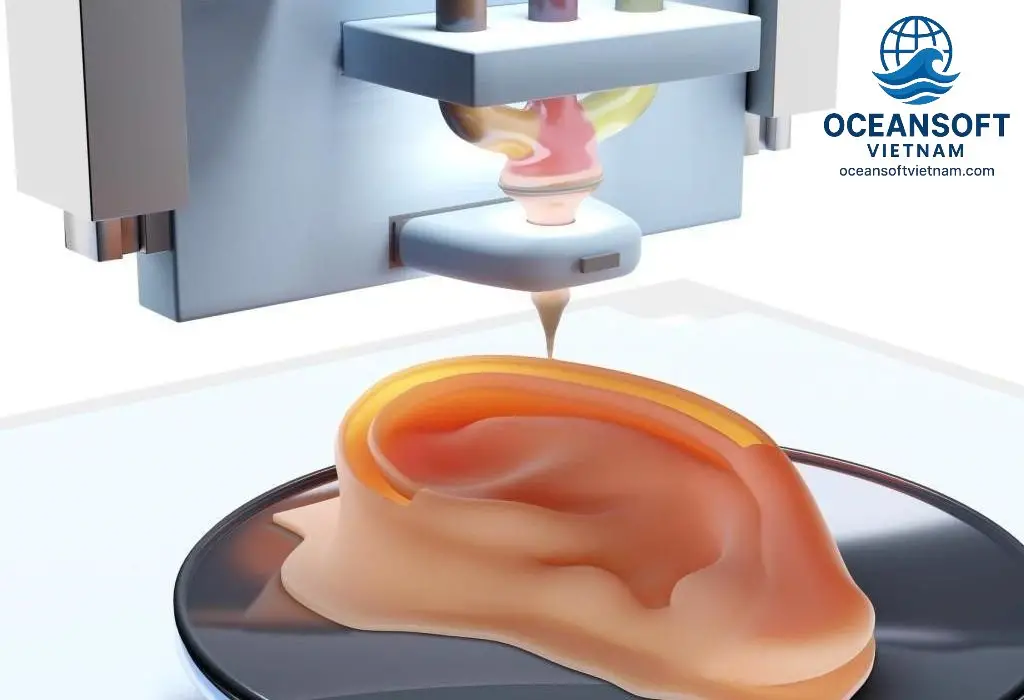
In: Máy in 3D sinh học sẽ lắng đọng bioink theo từng lớp, dựa trên mô hình thiết kế, để tạo ra cấu trúc 3D mong muốn. Có nhiều kỹ thuật in khác nhau, bao gồm in phun, in đùn và in laser, mỗi kỹ thuật phù hợp với các loại tế bào và vật liệu khác nhau.
Xử lý hậu kỳ: Sau khi in, cấu trúc được nuôi cấy trong lồng ấp sinh học để các tế bào phát triển và hình thành mô hoàn chỉnh. Các kích thích cơ học và hóa học có thể được áp dụng để kiểm soát quá trình tái tạo và phát triển của mô.
Các kỹ thuật Bioprinting phổ biến
In phun (Inkjet Bioprinting): Kỹ thuật này sử dụng nhiệt hoặc áp điện để phun các giọt bioink nhỏ lên bề mặt. In phun phù hợp với việc in các cấu trúc có độ phân giải cao, nhưng có thể gây tổn thương tế bào do nhiệt hoặc áp suất.
In đùn (Extrusion Bioprinting): Bioink được đẩy qua một vòi phun để tạo ra các sợi liên tục. Kỹ thuật này đơn giản và có thể in các vật liệu có độ nhớt cao, nhưng độ phân giải không cao bằng in phun.
In lập thể (Stereolithography): Sử dụng ánh sáng để trùng hợp các vật liệu polymer lỏng, tạo ra các cấu trúc 3D. In lập thể có độ chính xác cao, nhưng bị giới hạn bởi các loại vật liệu có thể sử dụng.
Ưu điểm của việc sử dụng tế bào tự thân
Việc sử dụng tế bào của chính bệnh nhân trong bioprinting mang lại nhiều lợi ích:
Giảm nguy cơ thải ghép: Do tế bào có nguồn gốc từ cơ thể bệnh nhân, hệ miễn dịch sẽ không tấn công hoặc đào thải cấu trúc được in.
Tương thích sinh học cao: Tế bào tự thân tương thích hoàn toàn với môi trường sinh học của bệnh nhân, giúp tăng cường khả năng tích hợp và chức năng của mô.
Y học cá nhân hóa: Bioprinting cho phép tạo ra các mô và cơ quan phù hợp với đặc điểm riêng của từng bệnh nhân, mở ra tiềm năng cho y học cá nhân hóa.
Ứng dụng của Bioprinting trong y học tái tạo
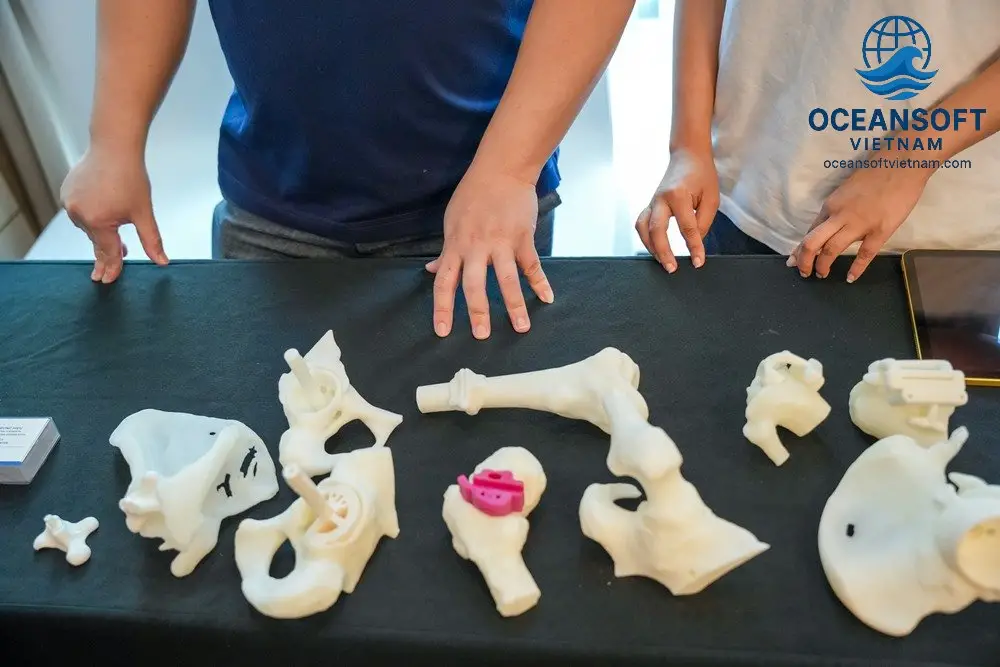
Tạo mô và cơ quan để cấy ghép
Một trong những mục tiêu lớn nhất của bioprinting là tạo ra các mô và cơ quan chức năng để cấy ghép, giải quyết tình trạng thiếu hụt nội tạng trên toàn cầu.
Da: Các nhà khoa học đã thành công trong việc in da người để điều trị bỏng nặng, giảm thời gian phục hồi và nguy cơ đào thải.
Sụn và xương: Bioprinting có thể tái tạo mô sụn và xương với độ chính xác cao, sử dụng kết hợp bioink và vật liệu cứng như canxi phosphat.
Mạch máu: Tạo ra các mạch máu nhân tạo là một thách thức lớn, nhưng bioprinting đang tiến gần đến việc in các cấu trúc mạch máu phức tạp để nuôi dưỡng các mô và cơ quan được in.
Nội tạng: Các nghiên cứu đang được tiến hành để in các cơ quan phức tạp như thận, gan và tim, mặc dù vẫn còn nhiều thách thức kỹ thuật cần vượt qua. Healshape đang phát triển túi ngực cấy ghép sinh học 3D từ tế bào của bệnh nhân.
Ứng dụng trong nghiên cứu và phát triển thuốc
Bioprinting cung cấp các mô hình 3D của mô và cơ quan người, cho phép các nhà nghiên cứu nghiên cứu bệnh tật và thử nghiệm thuốc một cách hiệu quả hơn so với các mô hình 2D truyền thống hoặc thử nghiệm trên động vật.
Mô hình bệnh tật: In các mô hình 3D của các khối u ung thư hoặc các mô bị bệnh khác để nghiên cứu cơ chế bệnh và phát triển các liệu pháp điều trị cá nhân hóa.
Sàng lọc độc tính của thuốc: Đánh giá tác động của thuốc lên các mô in 3D trước khi thử nghiệm trên người, giảm thiểu rủi ro và chi phí.
Y học cá nhân hóa: Phát triển các phương pháp điều trị và thuốc phù hợp với từng cá nhân, dựa trên đặc điểm sinh học của bệnh nhân.
Các ứng dụng khác
Phát triển bộ phận giả: In 3D có thể tạo ra các bộ phận giả tùy chỉnh, phù hợp với nhu cầu của từng bệnh nhân, với chi phí thấp hơn và thời gian sản xuất nhanh hơn so với phương pháp truyền thống.
Nha khoa: In 3D được sử dụng để tạo ra các mô hình răng, hàm giả, mão răng và các dụng cụ nha khoa khác, với độ chính xác và tương thích cao.
Đào tạo y khoa: Các mô hình in 3D của cơ quan và mô người được sử dụng để đào tạo sinh viên y khoa và bác sĩ, giúp họ thực hành các kỹ năng phẫu thuật và chẩn đoán một cách an toàn và hiệu quả.
Tế bào gốc và vai trò trong Bioprinting
Ứng dụng của tế bào gốc
Tế bào gốc đóng vai trò quan trọng trong bioprinting nhờ khả năng tự tái tạo và biệt hóa thành nhiều loại tế bào khác nhau.
Tạo nguồn tế bào: Tế bào gốc có thể được sử dụng để tạo ra một lượng lớn tế bào cho bioprinting, giải quyết vấn đề nguồn cung tế bào hạn chế.
Tái tạo mô: Tế bào gốc có thể biệt hóa thành các loại tế bào chuyên biệt để tái tạo các mô và cơ quan bị tổn thương.
Nghiên cứu và điều trị bệnh: Tế bào gốc giúp kiểm tra độ an toàn và chất lượng của thuốc, tái tạo mô cơ tim, phục hồi chức năng gan, điều chỉnh đường huyết, và nhiều ứng dụng khác.
Các loại tế bào gốc sử dụng trong Bioprinting
Tế bào gốc phôi (Embryonic Stem Cells – ESCs): Có khả năng biệt hóa thành mọi loại tế bào trong cơ thể, nhưng việc sử dụng chúng gây ra các vấn đề đạo đức.
Tế bào gốc trưởng thành (Adult Stem Cells): Có khả năng biệt hóa hạn chế hơn ESCs, nhưng dễ thu thập và ít gây tranh cãi về mặt đạo đức.
Tế bào gốc đa năng cảm ứng (Induced Pluripotent Stem Cells – iPSCs): Tế bào trưởng thành được tái lập trình để trở thành tế bào gốc đa năng, kết hợp ưu điểm của cả ESCs và tế bào gốc trưởng thành.